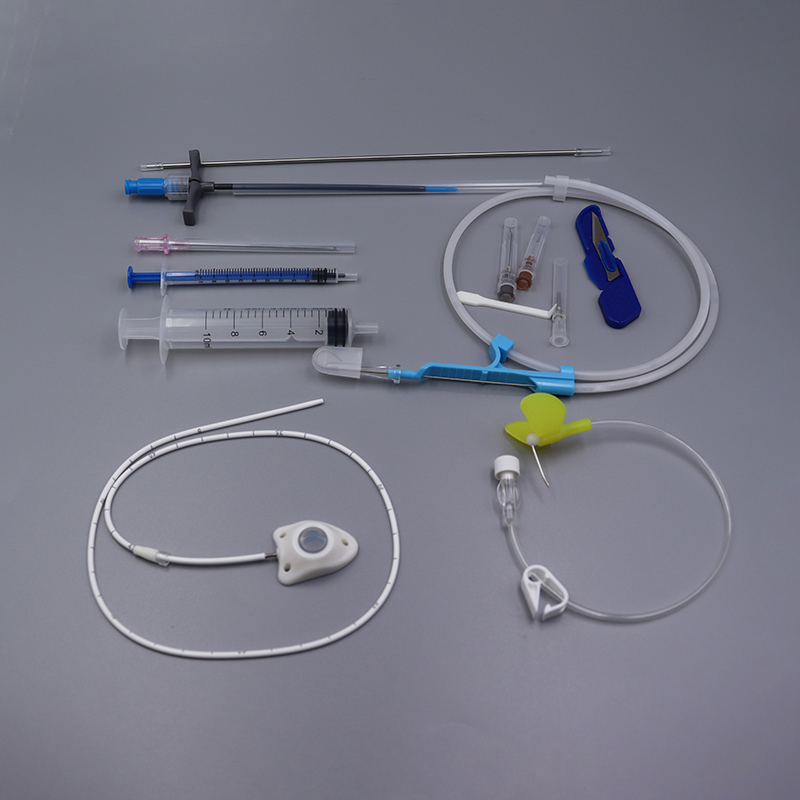
[Применение] Сосудистое устройствоимплантируемый портПодходит для химиотерапии под контролем визуализации при различных злокачественных опухолях, профилактической химиотерапии после резекции опухоли и других поражений, требующих длительного местного применения.
[Спецификация]
| Модель | Модель | Модель |
| I-6.6Fr×30cm | II-6.6Fr×35cm | III- 12,6Fr×30 см |
【Характеристики】Самогерметизирующийся эластомер держателя инъекционного катетера позволяет использовать иглы 22GA для имплантации порта до 2000 пункций. Изделие полностью изготовлено из медицинских полимеров и не содержит металла. Катетер обнаруживается рентгеновским излучением. Стерилизован этиленоксидом, одноразовый. Конструкция с защитой от обратного тока.
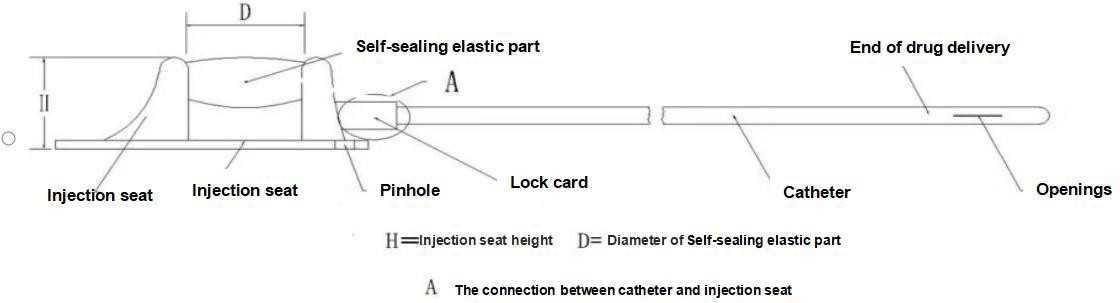
【Структура】Данное устройство состоит из инъекционного седла (включая самогерметизирующиеся эластичные элементы, элементы, ограничивающие прокол, фиксирующие зажимы) и катетера, при этом изделие типа II оснащено усилителем фиксирующего зажима. Катетер и самогерметизирующаяся эластичная мембрана имплантируемого устройства для доставки лекарственных средств изготовлены из медицинского силиконового каучука, а остальные компоненты — из медицинского полисульфона. На следующей схеме представлена основная структура и названия компонентов изделия, в качестве примера рассматривается тип I.
【Противопоказания】
1) Психологическая или физическая непригодность к хирургическому вмешательству в общих условиях.
2) Тяжелые нарушения свертываемости крови и кровотечения.
3) Количество лейкоцитов менее 3×10⁹/л
4) Аллергия на контрастные вещества
5) В сочетании с тяжелой хронической обструктивной болезнью легких.
6) Пациенты с известной или предполагаемой аллергией на материалы, входящие в состав упаковки устройства.
7) Наличие или подозрение на инфекцию, связанную с медицинским устройством, бактериемию или сепсис.
8) Лучевая терапия в месте предполагаемой имплантации.
9) Визуализация или введение эмболических препаратов.
【Дата изготовления】 См. этикетку продукта
【Срок годности】 См. этикетку продукта
【Способ применения】
- Подготовьте имплантируемый порт и проверьте, не истек ли срок годности; извлеките внутреннюю упаковку и проверьте, не повреждена ли она.
- Для вскрытия внутренней упаковки и извлечения продукта перед использованием следует соблюдать асептическую технику.
- Использование имплантируемых порт-устройств описано отдельно для каждой модели следующим образом.
ТипⅠ
- Промывка, вентиляция, проверка на герметичность.
С помощью шприца (иглы для имплантируемого порт-устройства) проколите имплантируемый порт-устройство и введите 5-10 мл физиологического раствора для промывания инъекционного отверстия и просвета катетера, а также для его удаления. Если жидкость не поступает или поступает медленно, поверните конец катетера, предназначенный для введения лекарственного препарата (дистальный конец), рукой, чтобы открыть порт для введения лекарственного препарата; затем загните конец катетера, предназначенный для введения лекарственного препарата, и продолжайте вводить физиологический раствор (давление не более 200 кПа), наблюдая за наличием утечки из инъекционного отверстия и соединения катетера. После того, как все окажется в норме, катетер можно использовать.
- Канюляция и перевязка
Согласно результатам интраоперационного обследования, катетер (конец для введения лекарственного препарата) следует ввести в соответствующий кровеносный сосуд в зависимости от локализации опухоли и с помощью нерассасывающихся швов надлежащим образом закрепить катетер в сосуде. Катетер должен быть надежно зафиксирован (в два или более прохода).
- химиотерапия и герметизация
В соответствии с планом лечения, внутриоперационный химиотерапевтический препарат можно вводить однократно; рекомендуется промыть место инъекции и просвет катетера 6-8 мл физиологического раствора, а затем 3-5 мл раствора. После этого катетер герметизируют 3-5 мл гепаринового раствора в концентрации 100-200 Ед/мл.
- Фиксация седла инъекционного винта
В месте опоры, на расстоянии 0,5–1 см от поверхности кожи, создается подкожная кистозная полость, в которую помещается и фиксируется инъекционный катетер, после чего кожа зашивается после обеспечения строгого гемостаза. Если катетер слишком длинный, его можно свернуть в кольцо на проксимальном конце и надежно зафиксировать.
ТипⅡ
1. Промывка и вентиляция
С помощью шприца (иглы для имплантируемого порт-устройства) введите физиологический раствор в инъекционное отверстие и катетер соответственно, чтобы промыть и удалить воздух из просвета, и понаблюдайте, насколько гладкая проводящая жидкость.
2. Канюляция и перевязка
Согласно результатам интраоперационного обследования, в соответствии с расположением опухоли следует ввести катетер (конец для введения лекарственного препарата) в соответствующий кровеносный сосуд и надлежащим образом перевязать катетер с сосудом нерассасывающимися нитями. Катетер должен быть надежно перевязан (в два или более прохода) и зафиксирован.
3. Соединение
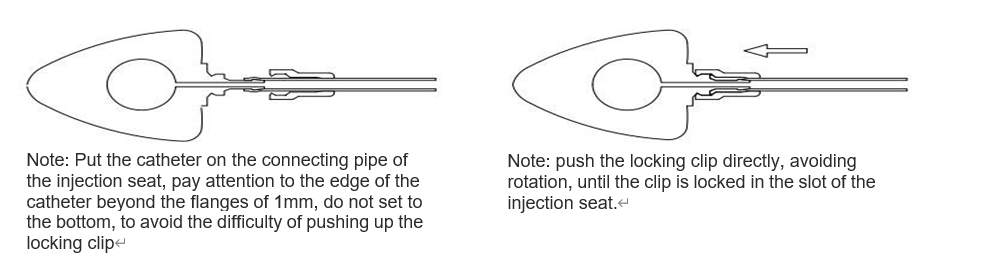
Определите необходимую длину катетера в зависимости от состояния пациента, отрежьте излишки с проксимального конца катетера (не дозирующего конца) и вставьте катетер в соединительную трубку инъекционного седла.
Используйте усилитель для фиксации, чтобы плотно прижать фиксирующую скобу к держателю инъекционного катетера. Затем осторожно потяните катетер наружу, чтобы убедиться в его надежной фиксации. Это делается, как показано на рисунке.
Рисунок ниже.
4. Проверка на герметичность
4. После завершения соединения сложите и закройте катетер с задней стороны фиксирующей защелки и продолжайте вводить физиологический раствор в инъекционное отверстие с помощью шприца (иглы для имплантируемого устройства доставки лекарств) (давление более 200 кПа). (Давление не более 200 кПа) проверьте, нет ли утечки из инъекционного блока и катетера.
Подключение и использование возможны только после того, как все будет в норме.
5. Химиотерапия, герметизирующая трубка
В соответствии с планом лечения, внутриоперационный химиотерапевтический препарат можно вводить однократно; рекомендуется повторно промыть инъекционное основание и просвет катетера 6–8 мл физиологического раствора, а затем ввести 3–5 мл физиологического раствора.
Затем катетер герметизируют, добавляя от 3 до 5 мл гепаринового физиологического раствора с концентрацией от 100 до 200 Ед/мл.
6. Фиксация седла инъекционного винта
В месте опоры, на расстоянии 0,5–1 см от поверхности кожи, была создана подкожная кистозная полость, в которую поместили инъекционное ложе и зафиксировали его, после чего кожу зашили, обеспечив строгий гемостаз.
Тип III
С помощью шприца (специальной иглы для имплантируемых порт-устройств) в имплантируемое устройство для доставки лекарств вводили 10–20 мл физиологического раствора, чтобы промыть инъекционное седло и полость катетера, удалить воздух из полости и проверить, не выделяется ли жидкость незаметно.
2. Канюляция и перевязка
В соответствии с результатами интраоперационного обследования, катетер следует вводить вдоль брюшной стенки, при этом открытая часть катетера, предназначенная для введения лекарственного препарата, должна войти в брюшную полость и находиться как можно ближе к целевой опухоли. Для перевязки и фиксации катетера следует выбрать 2-3 точки.
3. химиотерапия, герметизирующая трубка
В соответствии с планом лечения, во время операции можно однократно ввести химиотерапевтический препарат, после чего пробирку герметизируют 3–5 мл физиологического раствора с гепарином (100–200 Ед/мл).
4. Фиксация седла инъекционного винта
В месте опоры, на расстоянии 0,5–1 см от поверхности кожи, была создана подкожная кистозная полость, в которую поместили инъекционное ложе и зафиксировали его, после чего кожу зашили, обеспечив строгий гемостаз.
Введение лекарственных препаратов и уход
А.Строгое соблюдение асептики, правильный выбор места инъекции перед введением препарата и тщательная дезинфекция места инъекции.B. При инъекции используйте иглу для имплантируемого порт-устройства, шприц объемом 10 мл или более. Левым указательным пальцем коснитесь места прокола, большим пальцем натяните кожу, фиксируя инъекционное отверстие. Правой рукой держите шприц вертикально в игле, избегая тряски или вращения. Медленно вводите физиологический раствор 5–10 мл. Когда почувствуете, что игла опускается, и кончик иглы коснется дна инъекционного отверстия, проверьте плавность введения препарата (если это не происходит плавно, сначала проверьте, не заблокирована ли игла). Обратите внимание, не происходит ли при надавливании на окружающую кожу.
C. Медленно вводите химиотерапевтический препарат, убедившись в отсутствии ошибок. Во время введения следите за тем, не приподнимается ли или не бледнеет ли окружающая кожа, а также не возникает ли местная боль. После введения препарата следует удерживать его в течение 15–30 секунд.
D. После каждой инъекции рекомендуется промывать инъекционное отверстие и просвет катетера 6–8 мл физиологического раствора, а затем герметизировать катетер 3–5 мл гепаринового раствора (100–200 Ед/мл). При введении последних 0,5 мл гепаринового раствора препарат следует вводить повторно, чтобы система введения препарата была заполнена гепариновым раствором и предотвратить кристаллизацию препарата и свертывание крови в катетере. Промывать катетер гепариновым раствором следует каждые 2 недели в течение периода химиотерапии.
Е. После инъекции продезинфицируйте ушко иглы медицинским дезинфицирующим средством, накройте стерильной повязкой и следите за тем, чтобы местная область оставалась чистой и сухой, чтобы предотвратить инфицирование в месте прокола.
F. Обращайте внимание на реакцию пациента после введения препарата и внимательно наблюдайте за ним во время инъекции.
【Внимание, предупреждение и контент с элементами сексуального подтекста】
- Данный продукт стерилизован этиленоксидом и годен в течение трех лет.
- Перед использованием ознакомьтесь с инструкцией по эксплуатации, чтобы обеспечить безопасность применения.
- Использование данного изделия должно соответствовать требованиям соответствующих кодексов практики и правил медицинской отрасли, а установка, эксплуатация и удаление этих устройств должны осуществляться только сертифицированными врачами. Установка, эксплуатация и удаление этих устройств также должны осуществляться только сертифицированными врачами, а уход после установки трубки должен осуществляться квалифицированным медицинским персоналом.
- Вся процедура должна проводиться в асептических условиях.
- Перед процедурой проверьте срок годности продукта и внутреннюю упаковку на наличие повреждений.
- После использования продукт может представлять биологическую опасность. Пожалуйста, соблюдайте общепринятые медицинские практики и все соответствующие законы и правила обращения с продуктом и его использования.
- Во время интубации не применяйте чрезмерную силу и вводите катетер в артерию точно и быстро, чтобы избежать вазоспазма. Если интубация затруднена, используйте пальцы, чтобы поворачивать катетер из стороны в сторону во время введения трубки.
- Длина катетера, вводимого в тело, должна быть соответствующей: слишком длинный катетер легко скручивается под углом, что приводит к нарушению вентиляции, а слишком короткий может привести к его выпадению из сосуда при интенсивных движениях пациента. Если катетер слишком короткий, он также может выпасть из сосуда при энергичных движениях пациента.
- Катетер следует вводить в сосуд, используя более двух лигатур и обеспечивая надлежащую плотность натяжения, чтобы гарантировать плавное введение лекарственного препарата и предотвратить соскальзывание катетера.
- Если имплантируемый порт относится к типу II, соединение между катетером и инъекционным гнездом должно быть прочным. Если внутриоперационное введение лекарственного препарата не требуется, перед наложением швов на кожу следует провести пробное введение физиологического раствора.
- При разделении подкожной области необходимо обеспечить тщательный гемостаз, чтобы избежать образования местной гематомы, скопления жидкости или вторичной инфекции после операции; шов должен проходить не в месте инъекции.
- Медицинские клеи на основе α-цианоакрилата могут повредить материал инъекционной основы; не используйте медицинские клеи на основе α-цианоакрилата при обработке хирургического разреза вокруг инъекционной основы. Не используйте медицинские клеи на основе α-цианоакрилата при работе с хирургическими разрезами вокруг инъекционной основы.
- Следует проявлять крайнюю осторожность, чтобы избежать протечки катетера из-за случайного повреждения хирургическими инструментами.
- При пункции иглу следует вводить вертикально, использовать шприц объемом 10 мл или более, вводить препарат следует медленно, а иглу следует извлекать после короткой паузы. Давление при введении не должно превышать 200 кПа.
- Для имплантируемых устройств доставки лекарственных препаратов используйте только специальные иглы.
- Когда требуется более длительная инфузия или заместительная терапия лекарственными препаратами, целесообразно использовать одноразовое имплантируемое устройство для доставки лекарственных препаратов со специальной инфузионной иглой или тройником, чтобы уменьшить количество проколов и снизить негативное воздействие на пациента.
- Уменьшение количества проколов, снижение повреждения мышц пациента и самозапечатывающиеся эластичные элементы. В период прекращения инъекций препарата требуется введение антикоагулянта один раз в две недели.
- Данный продукт является одноразовым, стерильным, апирогенным, подлежит утилизации после использования; повторное использование строго запрещено.
- Если внутренняя упаковка повреждена или срок годности продукта истек, пожалуйста, верните его производителю для утилизации.
- Количество проколов для каждого инъекционного блока не должно превышать 2000 (22Ga). 21.
- Минимальный объем промывки составляет 6 мл.
【Хранилище】
Данный продукт следует хранить в нетоксичном, некоррозионном газообразном, хорошо проветриваемом, чистом помещении, предотвращая его сдавливание.
Дата публикации: 25 марта 2024 г.